Skleníkový efekt
Další videa z ekologie
Skleníkový efekt je pojem, který každý z nás slyšel. V tomto videu si ale na datech a grafech ujasníme, jaké plyny a jak moc tento efekt způsobují, a proč tak velmi záleží na životnosti skleníkových plynů v atmosféře. Budeme se bavit o vodní páře, oxidu uhličitém, metanu, ozónu, oxidu dusném a látkách typu CFC nebo HCFC.
Absorpční pásy skleníkových plynů
Základem, ke kterému se budeme často vracet, bude tento graf. Na první pohled vypadá velmi komplikovaně, tak trochu i je, ale rychle jej pochopíme. Tento graf se týká absorpčních pásů skleníkových plynů - tedy oblastí frekvencí záření, které skleníkové plyny pohlcují.

Oblast "Spektrální intenzita" nám ukazuje spektrum neboli složení záření, které prochází atmosférou. Nejvyšší frekvenci a i energii má tedy UV záření, pak zde máme viditelné světlo a nakonec tepelné, resp. infračervené záření. Červeně označené spektrum popisuje záření ze Slunce a vidíme, že se skládá z viditelného světla, trochu méně z infračerveného záření o vyšších frekvencích a taky z UV záření. Modrá plocha popisuje složení záření vycházejícího ze Země. To se nachází celé v infračervené oblasti.
Sekce "Celková absorpce a rozptyl" znázorňuje schopnost atmosféry a jejích složek pohlcovat nebo odrážet záření o různých frekvencích. Pod ním lze vidět, které plyny nepropouštějí záření a také při jakých frekvencích. Vidíme, že nejsilnějším skleníkovým plynem je vodní pára. Pak ji následuje CO2, který také nepropouští tepelné záření, následovaný metanem, oxidem dusným a ozónem. Máme zde také potvrzení toho, jak funguje ozónová vrstva. Vidíme, že ozón nepropouští velkou část škodlivého UV záření.
Vodní pára
Vodní parou rozumíme plynnou vlhkost ve vzduchu, nikoliv mraky. Mraky jsou totiž složeny z kapek vody v kapalném skupenství. Obsah vodní páry ve vzduchu se mění podle počasí a polohy na Zemi. Člověk ji svými aktivitami do atmosféry příliš nepřidává. Vodní pára se na skleníkovém efektu podílí v rozmezí 36-70 %.[2]
Proč ten rozptyl? Je to dáno tím, že absorpční pásy skleníkových plynů se totiž některých frekvencích překrývají, a proto není možné určit, který z daných skleníkových plynů ve vzduchu zrovna toto konkrétní záření pohltil.
Důležitou vlastností vzduchu je, že maximální množství vodní páry, které se ve vzduchu může udržet roste s teplotou. Vodní pára je jediný skleníkový plyn, jehož množství v atmosféře je fyzikálně omezeno. Pokud je jí v atmosféře hodně, tak zkondenzuje a vyprší se.
Oxid uhličitý
Oxid uhličitý vzniká přirozeně jako produkt dýchání rostlin a živočichů a hoření lesů, antropogenně (vlivem člověka) např. spalováním fosilních paliv a výrobou cementu. Při výrobě cementu se vápenec jako vstupní surovina tepelně rozkládá na CO2 a oxid vápenatý.
Přepočteno na 1 kg není CO2 příliš silný skleníkový plyn. Potíž je v tom, že v atmosféře setrvává velmi dlouho a atmosféra jej obsahuje hodně. Podle údajů NASA v ní vydrží 300-1000 let.[3] To dává úvahám o globálním oteplování nový rozměr, protože CO2, který vypustíme dnes, ovlivní klima na dlouhou dobu. Na skleníkovém efektu se CO2 podílí v rozsahu 9-26 %.[2]
Když se budeme bavit o koncentracích skleníkových plynů v atmosféře, tak je budeme vyjadřovat v jednotkách ppm. Tato jednotka pochází z anglického "parts per million", což můžeme volně přeložit jako miliontina. Pokud bychom chtěli např. 400 ppm převést na nám lépe uchopitelnou jednotku, mohli bychom také tuto hodnotu vyjádřit jako 0,04 %. Také se můžete setkat s jednotkou ppb - parts per billion, tedy miliardtina.
Koncentrace oxidu uhličitého stále rostou. Od roku 1750 se obsah CO2 v atmosféře zvýšil o 47 %.[4] Běžná koncentrace CO2 v atmosféře byla v posledních 800 000 letech v rozmezí 180-300 ppm.[5] K říjnu 2020 byla koncentrace CO2 415 ppm.[6]
Na obrázku níže také vidíme, že nárůst koncentrací CO2 v atmosféře časově koresponduje s nárůstem lidských emisí CO2. Jedná se o další z podpůrných důkazů vlivu člověka na klima. Jen k vysvětlení grafu dodám, že modrá a růžová křivka jsou v jiných jednotkách, tím pádem to, že se někde kříží, nemá žádný význam a je to dáno jen umístěním křivek.
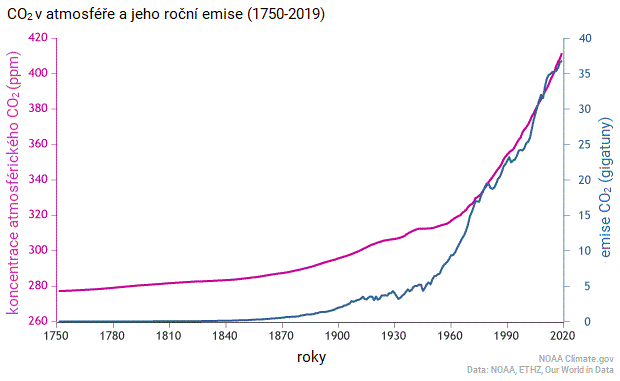
Oxid uhličitý a další skleníkové plyny navíc zesilují vliv vodní páry. Skleníkové plyny ohřevem atmosféry zvyšují schopnost vzduchu vodní páru v sobě udržet a také zesilují výpar vody. Vyšší množství vlhkosti ve vzduchu dále zesiluje skleníkový efekt a dále zvyšuje teplotu atmosféry, čímž vzniká pozitivní zpětná vazba.[16]
Metan
Metan je plyn, který přirozeně vzniká rozkladnými procesy v mokřadech a termitištích nebo lidskou činností (následkem chovu dobytka, pěstováním rýže nebo na skládkách). Na skleníkovém efektu má metan podíl v rozsahu 4-9 %.[2] Jeho koncentrace také rostou a v současnosti se pohybují kolem 1,9 ppm[13], takže zhruba 200x méně než CO2.
Zároveň víme, že metan je silnější skleníkový plyn než CO2. Jak tedy posuzujeme vliv jednotlivých plynů na globální oteplování mezi sebou?
Global warming potential
Protože je CO2 nejběžnější antropogenní skleníkový plyn, tak schopnost jiných plynů zesilovat skleníkový efekt se na něj přepočítává. K tomuto přepočtu slouží veličina GWP100, popř. GWP20, GWP500. Tato zkratka pochází z anglického global warming potential - potenciál globálního oteplování. Tato veličina bere v úvahu jak silně daný plyn pohlcuje tepelné záření a také jak dlouho daný plyn v atmosféře setrvá. Hodnota GWP nám říká, kolik kg CO2 by mělo na skleníkový efekt stejný vliv jako 1 kg daného plynu během 100 resp. 20 a 500 let.[8]
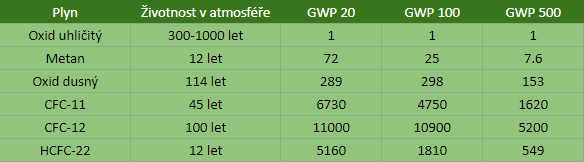
Metan je tedy ve 100letém horizontu 25x silnější skleníkový plyn než CO2.
Ozón
Ozón se na skleníkovém efektu podílí v rozsahu 3-7 %.[2] Jeho přítomnost v atmosféře je žádoucí, protože nepropouští UV záření. Na rozdíl od většiny ostatních plynů se nachází v stratosféře, tedy výše než ostatní skleníkové plyny. Ozón stratosféru pohlcováním tepelného záření mírně ohřívá. Před pár desítkami let měl ozón na mále, protože používáním freonů (látek, o kterých bude ještě řeč) se množství ozónu v atmosféře začalo snižovat. Tento fenomén známe pod označením ozónová díra.
Mezistátní dohodou, známou jako Montrealský protokol, byla výroba freonů zakázána. Dnes již máme první důkazy opřené o data, která potvrzují zacelování ozonové díry a pokles koncentrací CFC (tvrdých freonů) v oblasti ozonové díry.[10]
Oxid dusný (N2O)
Oxid dusný je také známý jako rajský plyn. Jedná se o velmi silný skleníkový plyn, naštěstí zatím v malých koncentracích v atmosféře - kolem 0,33 ppm.[9] Doba setrvání plynu v atmosféře je 114 let a ve stoletém horizontu je zhruba 300x silnější skleníkový plyn než CO2[8]. Dvě třetiny jeho emisí do atmosféry jsou přirozené a zbylou třetinu vnáší do atmosféry člověk skrze dusíkatá hnojiva a emise ze spalovacích motorů.[7]
Látky typu CFC a HCFC
Chlor-fluorované uhlovodíky a hydrochlorofluorované uhlovodíky – jinak označovány jako tvrdé a měkké freony. Tyto látky jsou umělého původu, přirozeně se na Zemi nevyskytují. Používaly se dříve jako chladiva do ledniček a klimatizací, plnidla plastů či izolanty. Jsou známé hlavně jako plyny narušující ozonovou vrstvu, jsou ale i silné skleníkové plyny s dlouhou dobou setrvání v atmosféře.[8]
I přes zákaz výroby těchto látek Montrealským protokolem koncentrace některých z nich rostou spolu s tím, jak stará zařízení ještě dobíhají.[11] I když jejich koncentrace v atmosféře jsou relativně nízké, tyto látky stojí za pozornost, protože když se podíváme na tabulku s GWP, tak 1 kg těchto látek má dopad jako tisíce kg CO2.[8]
Použité zdroje